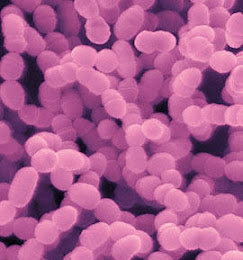
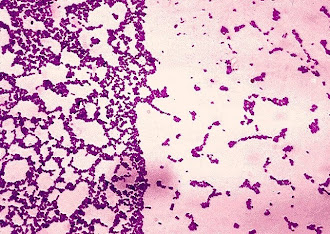
A placa para o cultivo contém o hagar Mitis Salivarius, o qual contém 20% de sacarose, o antibiótico bacitracina, que age em bactérias Gram + (menos os do grupo mutans). Também contém azul de tripan, o qual dá a coloração à placa e o corante cristal violeta que ajuda na identificação das bactérias Gram +.
Quando a saliva é colocada no hágar, deve-se usar a alça Drigalski para espalhar as bactérias na placa. Esse procedimento deve ser feito rapidamente, pois o hagar Mitis Salivarius é muito concentrado, portanto a água presente nas bactérias vai para o meio e elas ficam desidratadas, não ocorrendo crescimento nenhum.
A alça DEVE estar esterelizada. Coloca-se alça de drigalski no álcool e no fogo, colocando-a inclinada e nunca em posição horizontal para não esterilizar só a porção final mas toda ela.Esperar que a mesma esfrie para que as bactérias não sejam queimadas. Veja as fotos a seguir:
IMPORTANTE: TODOS OS PROCEDIMENTOS DEVEM SER REALIZADOS PERTO DA CHAMA!!


 Posicione o pipetador em 010 = 0,1ml.
Posicione o pipetador em 010 = 0,1ml. Coloque uma nova ponteira.
Coloque uma nova ponteira.
Pegue o tubo de ensaio 1 e a placa 1. Pegue,com o pipetador, do tubo 1 a quantidade exata de saliva diluida e aplique na placa de Petri 1.
Pegue,com o pipetador, do tubo 1 a quantidade exata de saliva diluida e aplique na placa de Petri 1.  Rapidamente com a alça de drigalski espalhe pela placa em forma de zigue-zague ou movimentos de vai e vem sempre girando a placa para que cresçam colônias por toda a placa.
Rapidamente com a alça de drigalski espalhe pela placa em forma de zigue-zague ou movimentos de vai e vem sempre girando a placa para que cresçam colônias por toda a placa.  Repita o procedimento em todos as placas. Tubo 2 na placa 2, tubo 3 na placa 3, tubo 4 na placa 4 e tubo 5 na placa 5. NUNCA esqueça de esterelizar a alça de drigalski antes de cada rastelagem.
Repita o procedimento em todos as placas. Tubo 2 na placa 2, tubo 3 na placa 3, tubo 4 na placa 4 e tubo 5 na placa 5. NUNCA esqueça de esterelizar a alça de drigalski antes de cada rastelagem.










 Jarra de cultivo em anaerobiose.
Jarra de cultivo em anaerobiose. Coloque todas as placas, com o hagar voltado para cima, dentro da jarra. Coloque um pedaço de papel alumínio e dentro dele um pedaço de algodão.
Coloque todas as placas, com o hagar voltado para cima, dentro da jarra. Coloque um pedaço de papel alumínio e dentro dele um pedaço de algodão. Coloque Álcool no algodão.
Coloque Álcool no algodão. Acenda o fósforo e coloque fogo no algodão para que após fechar o pote aja um ambiente em anaerobiose (apenas Gás Carbônico).
Acenda o fósforo e coloque fogo no algodão para que após fechar o pote aja um ambiente em anaerobiose (apenas Gás Carbônico). Tampe rapidamente a Jarra de cultivo em anaerobiose.
Tampe rapidamente a Jarra de cultivo em anaerobiose.

 Coloque a jarra para cultivo em anaerobiose com os meios de cultura dentro de uma estufa a 35º e aguarde 48 horas para o resultado final.
Coloque a jarra para cultivo em anaerobiose com os meios de cultura dentro de uma estufa a 35º e aguarde 48 horas para o resultado final.